CE认证的的跨国合用性次要笼盖欧洲经济区国度(冰岛、挪威、列支敦士登)、土耳其、以及部门中东和东南亚市场(阿联酋、沙特阿拉伯、新加坡等)。分歧国度对CE认证的接管程度分歧,例如仅部门产物需CE认证,而土耳其则完全采纳欧盟尺度。企业正在出口前需核实方针国的具体律例,连系本地认证要求以确保合规性。
跟着全球医疗器械市场向高端智能化、专科化成长,中国企业正加快建立以自从研发为焦点的合作力系统。通过提拔研发投入比例、深耕环节手艺范畴,企业正在立异赛道上取得本色冲破。

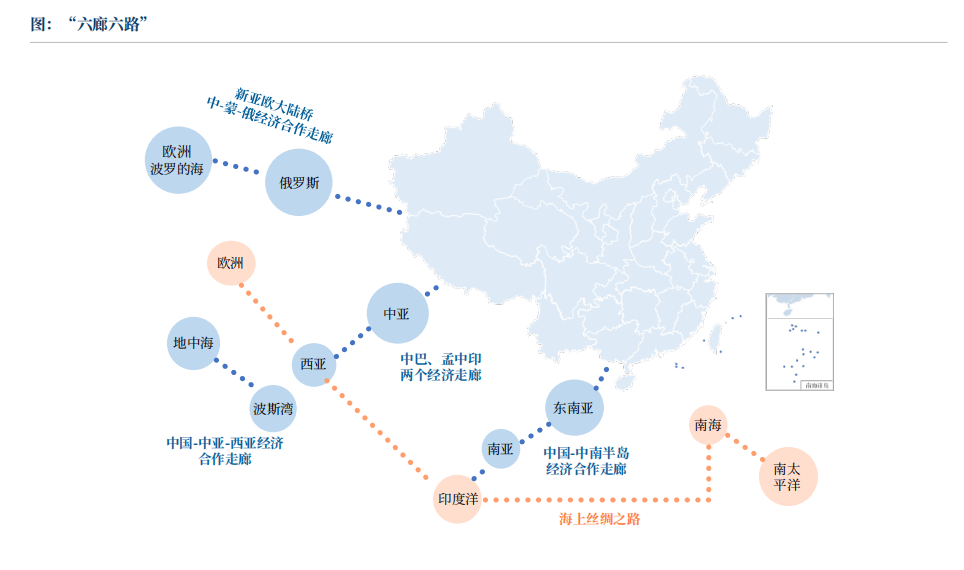
“一带一”及沿线月, “丝绸之经济带”和“21世纪海上丝绸之”的经济成长先后被提出。这一构思惹起了国际社会的普遍关心,并获得了相关国度的积极参取。这一,简称“一带一”,准绳,旨正在通过提拔交通、能源、收集等根本设备的互联互通,鞭策经济要素的流动、资本的无效设置装备摆设以及市场的深度融合。此举旨正在拓展区域合做的范畴、提拔合做程度、深化合做条理,建立一个、包涵、均衡、共享的区域经济合做系统,以推进经济增加和均衡成长。至2019年4月,“六廊六多国多港”互联互通架构已初步成立。目前,“一带一”已成为鞭策配合繁荣取成长的无效平台,正在多个范畴阐扬着积极效应。
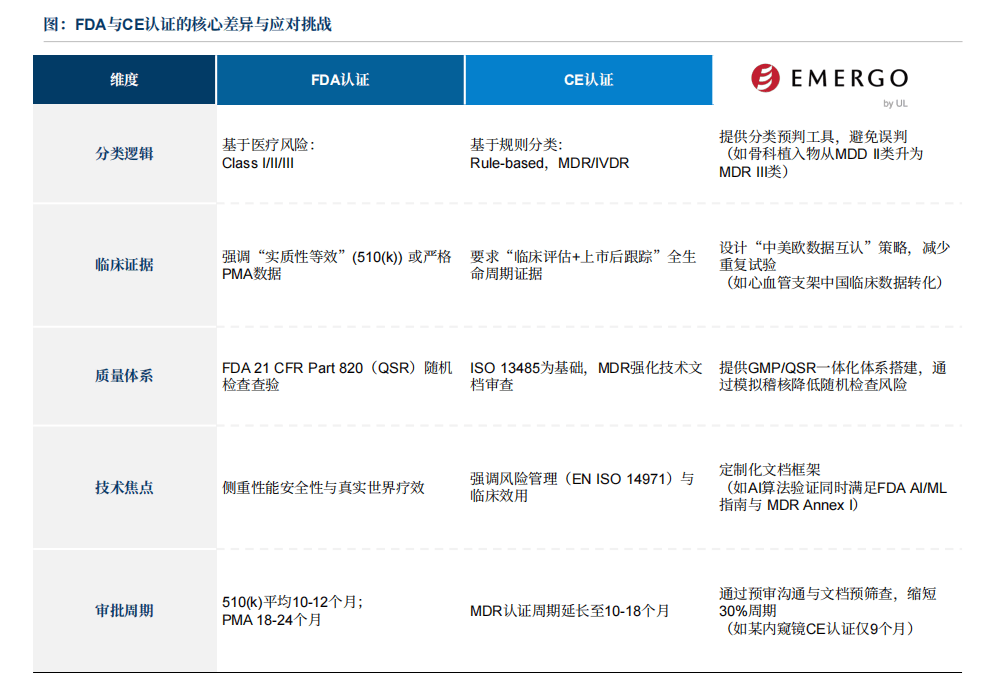
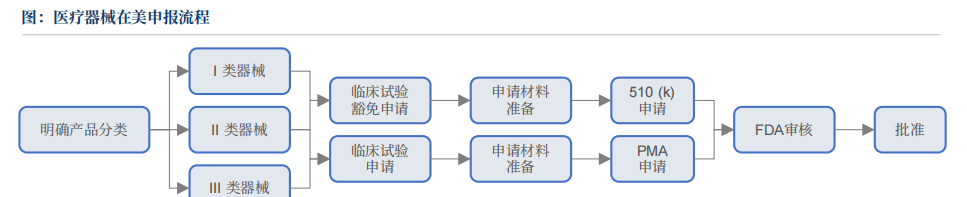
美国医疗器械监管系统以美国食物药品监视办理局(FDA)为焦点,建立了涵盖研发、出产、畅通全链条的严密监管收集,其焦点逻辑是通过科学评审取持续监视确保产物平安无效。FDA将医疗器械分为三类(Class I、II、III),其正在美申报流程次要包罗:确定产物分类、预备申请材料、递交510(k)或PMA申请等。此中PMA申请径是全球监管最严酷、成本和耗时也是最高的医疗器械上市许可路子之一,是对高风险医疗器械的最高审批尺度,合用于支持或维持生命、具有潜正在高风险的产物,中国获批产物少少,据行业专家阐发,每年通过PMA径获批的中国医疗器械产物仅为个位数程度。
因为全国13个省和地域各自运营的医保系统,对“医疗必需办事”的定义存正在差别,导致牙科、眼科和处方药等办事的笼盖范畴因地域而异。此外,非告急医治可能面对较持久待时间,而物理医治等部门办事凡是需公费或通过私家安全弥补。虽然系统以公共医疗为焦点,但跨省就医法则和弥补安全的利用仍是居平易近需留意的环节问题。
印度医疗系统正在建立普惠医疗收集的道上正持续摸索,通过PM-JAY国度健康保障打算为40%贫苦生齿建起住院费用保障网,展示出建立“全平易近医疗”框架的计谋决心。印度医疗市场呈现多元成长态势,私立医疗机构以75%的市场份额成为主要办事供给方,其高端诊断设备(CT/MRI/PET)的设置装备摆设劣势客不雅上提拔了全体医疗办事程度,但也将导致手艺资本进一步向付费能力强的群体集中。正在医疗总收入布局中,私家公费占比高达75%,公共收入仅占25%。医疗投入强度显著低于全球基准线。
美国的医疗安全系统次要由公共医疗安全和私家医疗安全两大类型形成 , 公共医疗安全次要包罗联邦医疗安全(Medicare)和医疗补帮(Medicaid)。私家医疗安全则由私家健康安全公司供给,笼盖了大部门劳动春秋生齿。正在医保付费模式上,美国采用按病种付费(DRGs)预付费体例。DRGs模式通过事后设定每种疾病的医治费用,激励医疗机构优化资本设置装备摆设,削减不需要医疗收入。同时也存正在一些间接向美国医疗安全和医疗补帮办事核心(CMS)申请特定付费的机制,这些机制对于推进立异医疗器械的临床使用和研究至关主要。好比凡是由医疗器械制制商倡议的新手艺附件领取(NTAP)等,经多部分审核后可申请领取器械研究及办事费用,进而加快临床研究。
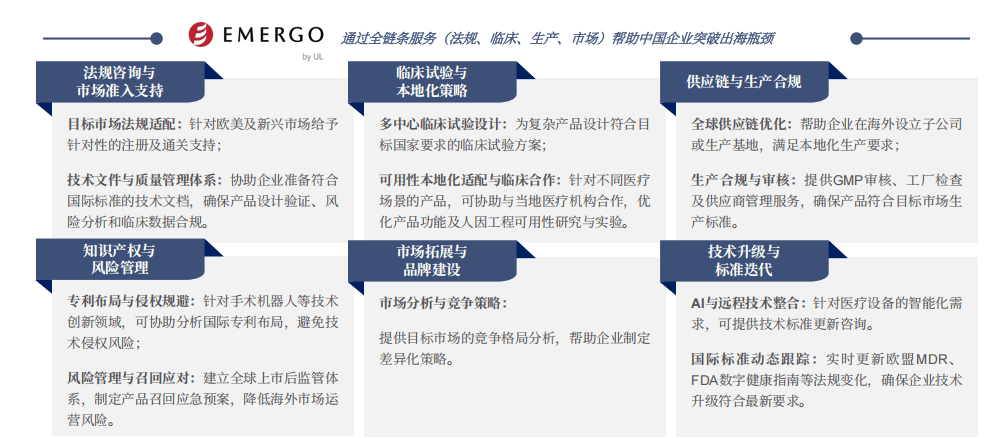
起首,精准定位方针市场至关主要。企业不再单一市场,而是深切调研医疗需求、律例及市场,为分歧市场定制出海径及产物组合。其次,建立本土化运营系统是提拔品牌认知的环节。通过成立合做伙伴关系、设立分支机构、组建当地团队,企业能更好地舆解本地需求,供给贴合本地文化的办事,并快速响应市场变化。此外,积极参取国际学术交换、行业展会,以及使用数字化营销手段,如多语种官网、社交推广、收集曲播等,均有帮于提拔品牌的专业抽象、国际声誉、出名度和佳誉度。通过这些策略,中国医疗器械企业正以立异、专业、靠得住的抽象,正在全球医疗市场博得一席之地。
中国医疗器械企业正通过计谋升级加快出海历程,以手艺立异驱动全球合作力提拔。企业持续加大正在人工智能辅帮诊断、微创介入器械、3D打印定制化植入物及可降解生物材料等范畴的前沿研发投入,同步深化“一带一”沿线市场洞察,针对下层医疗可及性需乞降区域多发病症特征,加速本土化临床尝试取产物注册认证。这一趋向不只鞭策了国产器械从成本劣势向价值立异转型,更通过建立全球生态链,沉塑全球医疗科技财产款式。
日本医疗器械的采购取订价系统次要依托于国度健康安全轨制,所有医疗器械产物正在进入市场前必需获得医保报销资历,这也使得采购往往由各医疗机构按照国度的医保领取价进行构和或投标采购,从而实现价钱上的集中管控;正在订价方面,日本自1993年建建功能分组报销轨制以来,通过将具有类似功能的器械归为统一组,并采用比力法取成本核算法相连系,同时参考外国平均价钱(FAP)进行价钱调整,每两年按期修订医保领取价以节制全体医疗费用,并对立异产物通过设定手艺加成或开设新类别予以激励,从而正在确保医保收入受控的同时,鞭策医疗器械的持续手艺改革 。
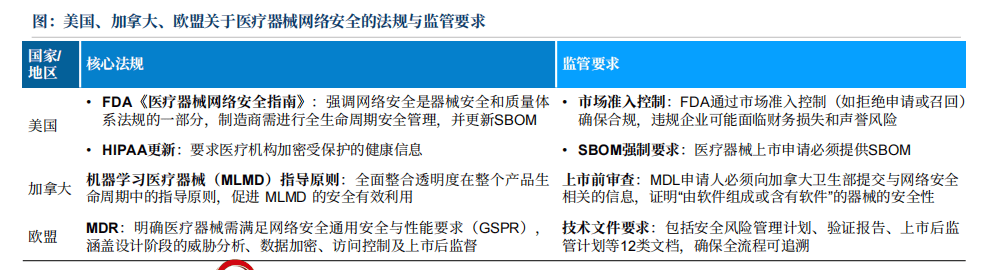

医疗器械先辈消息手艺的整合极大地改善了医疗健康行业,为医疗健康和相关办事带来了显著的效率及结果提拔。可是,高科技消息手艺的整合也给患者、医疗保健供给者和器械开辟商及制制商带来了一系列新的挑和。当前,医疗行业已成为黑客和收集犯罪的次要对象,这可能危及私家和保密的医疗数据,将患者的平安和健康置于之中。按照Verizon发布的《2025数据泄露查询拜访演讲》,医疗行业全年发生1710起平安事务,系统入侵(含软件)为首要泄露缘由。2024年2月,结合健康集团子公司Change Healthcare收集,形成了8。72亿美元的财政丧失和约1。9亿美国人的医疗数据泄露,成为美国汗青上最大的医疗数据泄露事务。
中国医疗器械企业正通过策略持续提拔跨文化沟通能力,以律例顺应、文化融合、经商洞察等维度建立全球化成长基石。
日本的医疗系统成立正在“全平易近医疗安全”根本之上,其焦点是通过全体国平易近配合分险费用(包罗被安全人的家眷做为被扶养人从动纳入保障范畴),建立互帮共济的医疗平安网。患者只需持有一张安全证即可选择任何医疗机构就诊,正在领取窗口现付比例费用后,即可平等获得诊疗办事、药品供给等需要的医疗项目,确保国平易近能无不同地获得根本医疗保障。
欧友邦浩繁,居平易近流动屡次。因而正在欧盟,社会保障和医疗安全凡是由经济情况和栖身地决定,而非国籍。欧洲医疗系统融合了多种模式,包罗公费医疗安全、社会医疗安全、夹杂型医疗安全等,为和外籍人士供给多样化办事。
欧盟对医疗器械实施严酷的同一监管系统,以《医疗器械律例》(MDR EU 2017/745)和《体外诊断医疗器械律例》(IVDR EU 2017/746)为焦点框架,代替原有的医疗器械指令,大幅提拔了监管要求。该系统按照产物风险品级将医疗器械分为I类(低风险)、IIa类(中低风险)、IIb类(中高风险)和III类(高风险),体外诊断设备则零丁按IVDR分类,此中高风险产物必需通过通知布告机构(Notified Bodies)认证,低风险产物可由制制商声明。监管沉点包罗加强临床数据要求、成立可逃溯性更强的欧洲医疗器械数据库(EUDAMED)、强化上市后监视等。
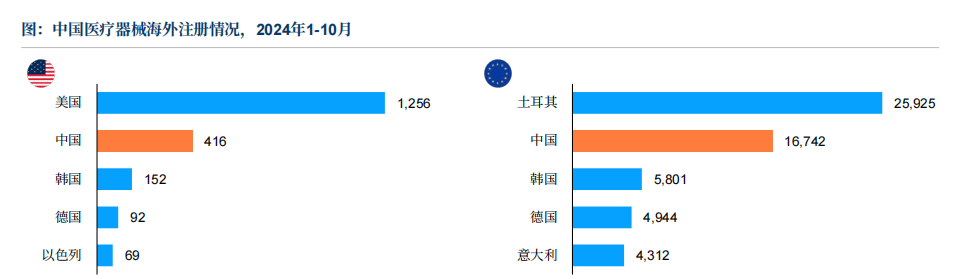
近年来,中国医疗器械企业加快取国际尺度接轨,积极获取FDA和CE认证,显著提拔了产物国际合作力,并操纵这些认证的全球承认度,建立起海外注册的快速通道。数据显示,中国企业正在FDA和CE认证数量上已位居全球前列。这不只意味着产物手艺达到国际先辈程度,更主要的是构成了市场准入的联动效应。
FDA注册(美国市场)和CE-MDR/IVDR(欧盟及全球大都地域)是法令强制的准入前提,未获认证即无法发卖。认证标记是企业手艺实力取质量许诺的全球“信赖背书”,将间接影响病院采购、医保笼盖及患者选择。头部企业通过认证建立产物壁垒,中国厂商必需冲破认证壁垒才能参取国际合作。对于企业来说。
的全平易近医疗保健系统(Medicare)由根据《卫生法》确立根基准绳,并由各省和地域具体办理。该系统通过税收筹集资金,笼盖所有和永世居平易近,答应他们凭健康卡免费享受需要医疗办事,如诊疗、住院和手术。







